
本文详细讲述了酵母表达表现型Mut+和Muts,酵母表达同源重组方式整合分析,酵母表达载体选择及其与大肠杆菌表达系统的区别,酵母表达原理及酵母蛋白表达实验SOP。
酵母表达系统是真核表达蛋白的常用系统之一,具有真核表达系统的许多优点:如蛋白加工折叠、翻译后修饰等。且酵母蛋白表达的操作较哺乳动物来说相对简单。同为酵母表达系统,毕赤酵母表达系统比酿酒酵母表达系统表达水平更高且可进行细胞的高密度培养。巴斯德毕赤酵母是近几年发展起来的较为完善,被广泛用来表达外源蛋白的甲醇营养型酵母表达系统。(下文所提到的酵母蛋白表达均为巴斯德毕赤酵母)
酵母蛋白表达与大肠杆菌表达部分不同,大肠杆菌表达只需将质粒/载体转入到宿主菌体内,其载体携带复制原点随着宿主染色体的复制而复制,可以稳定存在。而酵母表达相对复杂,设计的质粒/载体均不带有酵母自身复制原点,因此如果直接导入到宿主菌中,不能稳定存在。所以必须将质粒/载体线性化,以同源重组的方式与宿主菌的染色体进行整合,这样外源基因才能够稳定存在,而且同源重组一旦形成会很稳定,在通过后期的筛选排除没有整合成功的质粒/载体和宿主菌,挑选整合成功并能够高表达的重组转化子,某种程度上与哺乳动物稳定细胞系构建原理类似。
在毕赤酵母表达系统中,乙醇氧化酶有两种基因编码,即AOX1和AOX2。细胞中绝大多数乙醇氧化酶活力有AOX1提供,菌株利用甲醇的速度主要由AOX1基因表达的AOX1蛋白提供。当AOX1缺失,只存在AOX2时,大部分的乙醇氧化酶活力丧失,这种细胞利用甲醇能力低,在甲醇培养基上生长缓慢的菌株表现型为Muts。存在AOX1,细胞利用甲醇正常生长,在甲醇培养基上生长较快,这种菌株表现型为Mut+,这就是甲醇营养型毕赤酵母表达两种Muts和Mut+产生的原理。
GS115、KM71、SMD1168是常用的表达宿主菌,均为甲醇诱导型。他们都是组氨酸缺陷型,如果表达载体上带有组氨酸基因,可以补偿宿主菌的组氨酸缺陷,所以可以在不含组氨酸的培养基上筛选重组转化子。在以葡萄糖或者甘油等为碳源的培养基上生长时,AOX1基因的表达受到抑制,而在以甲醇为唯一碳源时,宿主菌的AOX1基因被强烈诱导,使目的基因大量表达。
毕赤酵母的最适生长温度为28-30℃,诱导期间超过32℃,不利于蛋白表达,并可能导致细胞死亡。Muts和Mut+菌株在没有甲醇存在的情况下生长速率一样,存在甲醇的情况下,AOX1启动子被强烈诱导,Mut+较Muts生长更快(4-5倍)。
酵母表达产物有胞内表达和分泌到胞外表达两种方式,这取决于表达载体的选择和构建是否带有信号肽,可根据基因表达的定位及目的选择合适的酵母蛋白表达载体。
① 胞内表达载体:主要包括pPIC3、pPICZ、pPSC3K、pHIL-D2等。该类载体将目的基因表达在胞内,可避免酵母的糖基化,适合于通常在胞浆表达或不含-S-S-的非糖基化蛋白,较胞外分泌表达水平高但纯化相对复杂。
② 分泌到胞外表达的载体:pPIC9、pHIL-S1、pYAM75P等。酵母本身分泌的外源蛋白很少,将外源蛋白分泌到胞外,有利于目的蛋白的纯化和积累。常用的分泌信号序列由89个氨基酸组成α交配因子的引导。
③ 多拷贝插入表达载体:pPIC9K、pPIC3.5K。某些情况下,重组基因的多拷贝整合能够增加蛋白的表达量。
想实现表达重组蛋白使其具体天然的N端,将目的基因直接连接在Kex2蛋白酶切位点之后。Kex2蛋白酶切位点在信号肽序列中谷氨酸和精氨酸连接处:Glu-Lys-Arg*Glu-Ala-Glu-Ala *位置为Kex2蛋白酶的酶切位点
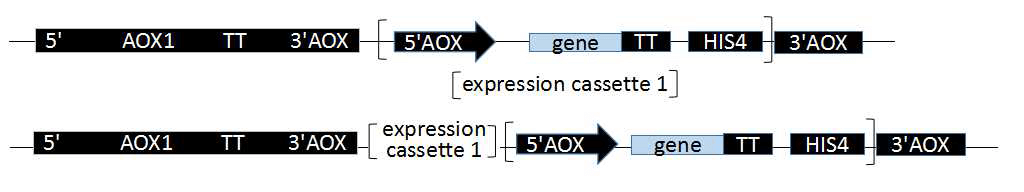
毕赤酵母能够高效的表达外源基因,是因为其具有强启动子乙醇氧化酶启动子(AOX1和AOX2)。AOX1和AOX2及其产生的Muts和Mut+表现型前文已经叙述过。AOX1受甲醇的诱导和葡糖糖或甘油的抑制。毕赤酵母表达的外源基因位于酵母染色体上,通过把构建的质粒/载体线性化(主要采用酶切),通过同源重组的方式整合到启动子AOX的下游,一般是插入到5’AOX启动子和转录终止子信号之间的单克隆位点。
质粒/载体和酵母表达基因图谱
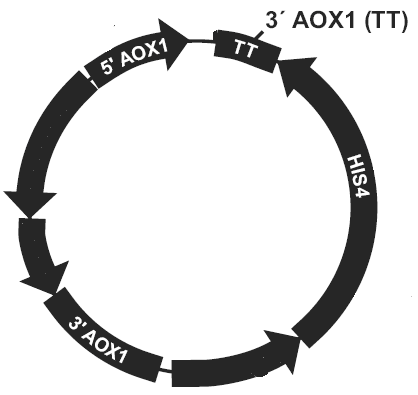
图1:载体图谱:5’AOX1启动子位点,
转录终止子TT,3’AOX1位点

图2:酵母宿主菌基因
在酵母宿主菌基因组的下游或者上游插入一个或多个质粒载体基因。如插入的质粒载体不破坏酵母宿主菌基因本身的AOX1,因此重组转化子的表现型不变为Mut+,反之为Muts。

图3:重组质粒插入3’AOX1
酵母宿主菌的AOX1启动子位点被质粒/载体基因完全替代,原有的酵母AOX1启动子被破坏,表现型为Muts,取代其的是质粒/载体基因组上的PAOX,目的基因,HIS4表达序列。取代事件发生的不如基因插入事件发生的多。

图4:AOX1位点被替换

简单来说就是质粒/载体基因的多次插入(插入到酵母宿主菌基因组上),自发概率很低
培养好的酵母宿主菌和构建好的质粒进行同源重组的转化方法有以下几种,都是基于线性化质粒/载体之后,线性化是转化的第一步,用限制酶酶切。
| 转化方法 | 转化效率 | 是否会多拷贝整合 | 操作 |
| 原生质体法 | 105 | 是 | 操作复杂 |
| 电穿孔法(电击) | 105 | 是 | 操作方便 |
| PEG诱导转化 | 103 | 否 | 操作方便 |
本文的酵母蛋白表达是简单叙述实验的主体流程,详细的标准操作流程见蛋白表达专题总页:酵母蛋白表达步骤(SOP)。
对质粒进行不同方式的转化需要制备不同的感受态细胞状态。且酵母表达的感受态细胞最好现做现用,感受态对转化效率有很大影响。在酵母表达SOP中包括电转,PEG1000和原生质法三种转化的感受态细胞制备方法。
包括三个转化方法操作步骤:原生质法转化,电转化,PEG1000
对转化后的酵母宿主菌进行筛选,筛选出成功实现同源重组的转化子,进行诱导表达
详细的酵母蛋白表达标准操作流程见蛋白表达专题总页酵母蛋白表达SOP
返回蛋白表达专题

新利在线官网 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策