
对于分子生物学来讲,生物分析手段的发展,是阐明机理的必要条件。在研究分子间相互作用的道路上,人们不断探索,总结出很多方法,免疫技术,晶体衍射,核磁共振等。1948年,荧光共振能量转移(Fluorescence resonance energy transfer,FRET)理论被首次提出,它可以测定1.0-6.0nm距离内分子间的相互作用。1967年,这一理论得到了实验验证,将1.0-6.0nm的距离称为光学尺。二十世纪八十年代出,通过科学家的不断探索,Fret技术成功运用到蛋白质结构的研究中。自Fret荧光共振能量技术诞生以来,已结合多种先进的技术和方法,如电子显微镜,X射线衍射等,推动了分子生物学检测手段的发展。
荧光共振能量转移技术,是采用物理方法去检测分子间的相互作用的方法。他适用于在细胞正常的生理条件下,验证已知分子间是否存在相互作用。此方法的检测原理如下;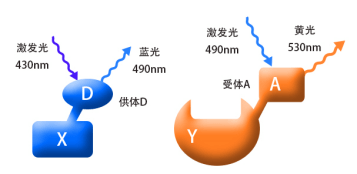
将我们要检测的蛋白(如图X和Y),分别偶联上D和A荧光蛋白,D和A是一对荧光物质,我们称之为供体(donor)和受体(acceptor)。当用430nm的紫光去激发X融合蛋白时,它能够产生490nm的蓝色荧光;同样,当我们用490nm的蓝光去激发Y融合蛋白时,它能够产生530nm的黄色荧光。(结合图1) 。
当蛋白X和Y间没有相互作用时(两者的空间距离>10nm),融合蛋白X和Y分别产生相应的荧光而被检测到,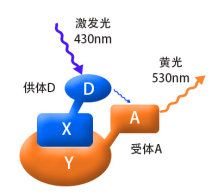 如果蛋白X和Y间存在相互作用(两者的空间距离需<10nm,结合图2),用紫光激发融合蛋白X其产生的蓝光会被融合蛋白Y吸收,从而产生黄色荧光,这时,在细胞内将检测不到蓝色荧光的存在。这时因为能量从X融合蛋白转移到了Y融合蛋白,这就是荧光共振能量转移技术。
如果蛋白X和Y间存在相互作用(两者的空间距离需<10nm,结合图2),用紫光激发融合蛋白X其产生的蓝光会被融合蛋白Y吸收,从而产生黄色荧光,这时,在细胞内将检测不到蓝色荧光的存在。这时因为能量从X融合蛋白转移到了Y融合蛋白,这就是荧光共振能量转移技术。
一个理想的Fret相互作用体系,要求要有一对合适的荧光物质, 即供体的发射光谱与受体的吸收光谱有明显的重叠。且当供体的激发波长时对受体无影响,供体和受体的发射光谱要完全分开,否则容易造成光谱干涉,而使反应体系不稳定。目前,较为常用的供体-受体分子对,主要有绿色荧光蛋白类(GFPs)和染料类。绿色荧光蛋白类有CFP-YFP,BFP-GFP,BFP-YFP等,染料类的有Cy3-Cy5,FITC-Rhodamine等。且这些荧光物质要能够标记在研究对象上。
| 优点 | 缺点 |
|---|---|
| 在活细胞的正常生理条件下进行检测,观察大分子在细胞内的构象变化与相互作用,并弥补了需破碎细胞检测相互作用的缺点; 灵敏度高,可实现对单细胞水平的研究,研究单个受体分子; 可与多种仪器和技术结合使用,如显微镜,色谱技术,电泳,流失细胞技术等; |
应用比较局限,一般需要在待检测分子上偶联荧光物质(加上标记); 对实验要求较高,如供受体的光谱重叠不好,会导致荧光干扰,对供受体的抗干扰能力,水溶性等要求高; 需要不断探索合适的供体和受体,且能够标记分子; 难以观察瞬时的分子间作用,检测要求大量的样品; |
以荧光物质CFP(供体)-YFP(受体)为例,检测AB蛋白在细胞内的相互作用。

新利在线官网 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策